Propriétés
L'hémoglobine à la propriété de réagir avec le dioxygène mais,
cette réaction est réversible ce qui permet un transport facile du dioxygène
Hb+O2 --> HbO2
HbO2-->Hb+O2
La molécule ainsi obtenue (HbO2) est appelée oxyhémoglobine.
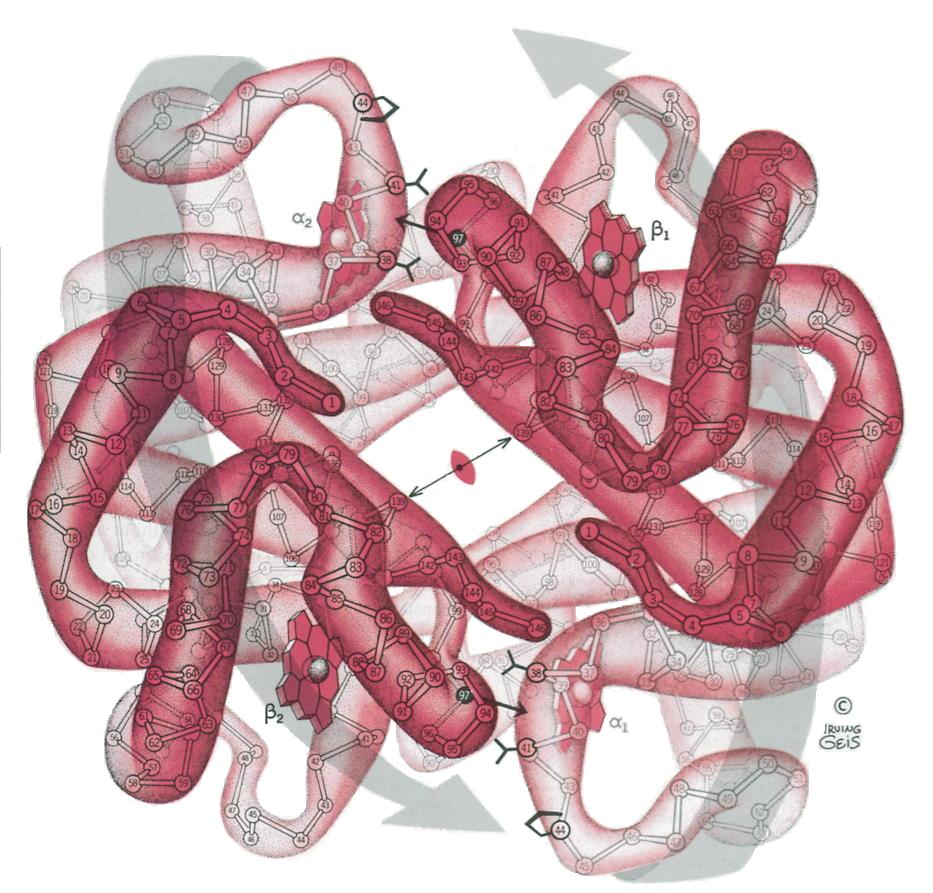
ci contre la photo de l'oxyhemoglobine
Chaque molécule d'hémoglobine est dite saturée en dioxygène lorsque les quatre
hèmes ( voir structure ) ont fixés chacun une molécule de dioxygène.
Ainsi le pourcentage de saturation est directement lié à la pression partielle
en dioxygène (PO2)
Au repos, la PO2 est très importante dans le sang artériel (allant des poumons vers les cellules)
en effet elle est de 105mm de mercure, ce qui entraine une saturation de l'hémoglobine à 98%
Dans les cellules musculaires au repos, la pression partielle de dioxygène n'est plus que de
40mm de mercure, cela permet donc un passage facile du dioxygène du sang vers les
muscles par simple différence de pression (du milieu ou la pression est la plus importante
vers le milieu ou la pression est la moins importante). Cependant le transfert n'est pas
total et il revient au poumon 70% d'oxyhémoglobine.
De plus l'organisme est très bien fait, car même à PO2 égales, lorsque l'on se trouve dans
des milieux ou la concentration en dioxygène est assez faible par exemple, il y a quand même
un passage du dioxygène vers les muscles, comme le prouve la courbe ci dessous.
En effet a PO2 égale on remarque que la saturation de la myoglobine (protéine receptrice
du dioxygène au niveau des muscles est toujours supérieure à celle de l'hémoglobine, donc
son affinité pour le dioxygène est supérieure et il y a passage du dioxygène de l'hémoglobine
vers la myoglobine (donc du sang vers les muscles).

Quand le muscle est contracté, la concentration intramusculaire du dioxygène diminue, et,
par conséquent la différence de pression entre le sang et les tissus augmentent, la dissociation
de l'oxyhemoglobine en est alors grandement facilitée.
De plus, le rythme cardiaque s'accelèrent
et donc et il y a un "relayage" plus important des hémoglobines.
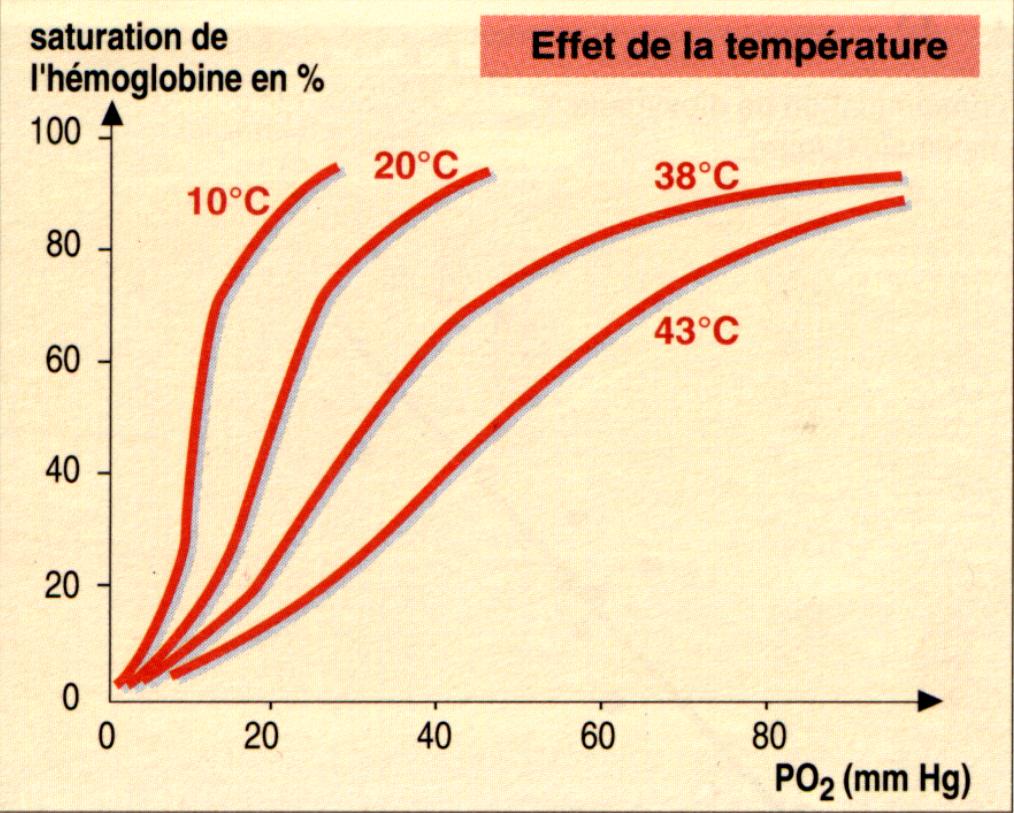
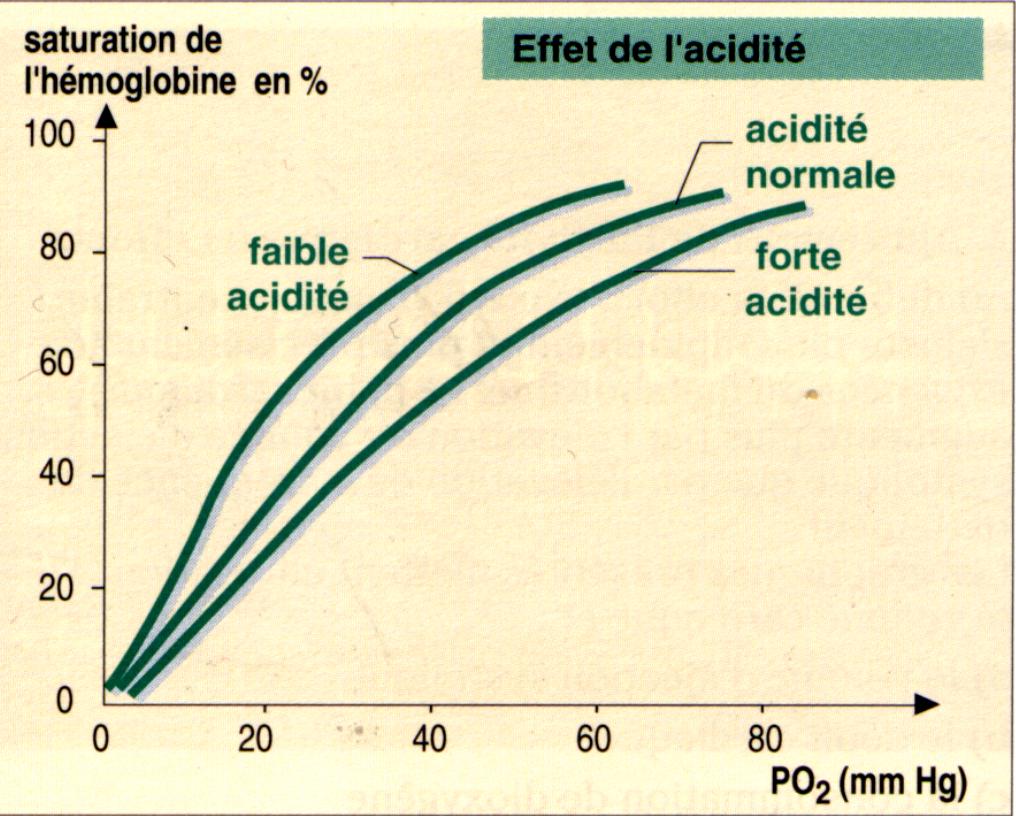
D'autre part le travail du muscle provoque une élévation thermique locale et une grande
libération d'acide lactique et de dioxyde de carbone qui aident également la dissociation
de l'oxyhemoglobine. Effectivement, comme le montre les courbes, à pression égale, la
saturation de l'hémoglobine est d'autant plus faible que l'acidité et la température sont
élevées, l'hémoglobine va donc se "déssaturer" davantage.