Structure
L'hémoglobine est un tétramère constituée de quatre sous-unités qui sont appellée globines.
Chaque sous unité est composé d'un atome de fer coordiné par
+ une porphyrine
+ une chaine protéique
+ éventuellement une molécule de dioxygène, de monoxyde de carbone et de monoxyde
d'azote .
La structure spatiale de ces sous-unités a été remarquablement conservée depuis l'apparition
de la molécule ancestrale ( voir historique ).
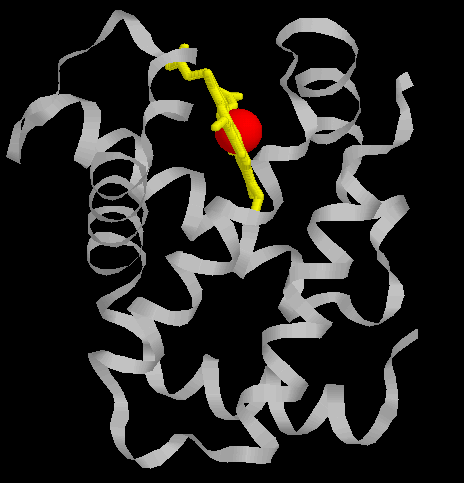
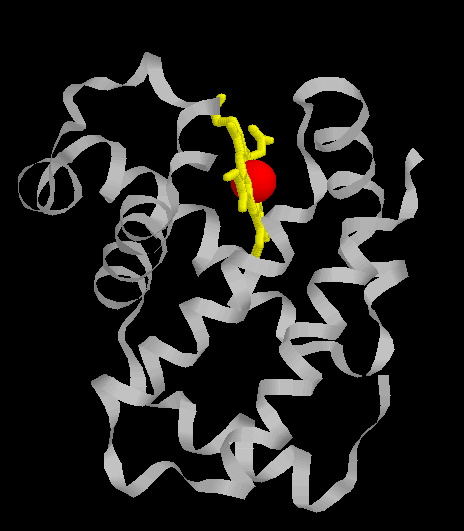
Ci dessus les deux types de sous unités que l'on rencontre dans une molécule d'hémoglobine
, la globine alpha(à gauche) composée d'une chaine proteique alpha en gris, d'une porphyrine er jaune et d'un atome de fer
en rouge et une globine beta (a droite) composée d'une chaine proteique beta en gris, d'une porphyrine en jaune et d'un atome de fer
en rouge.
La chaine protéique
L'hémoglobine est composée de quatre chaines protéiques : deux chaines alpha et deux chaines beta
La chaine alpha présente 141 acides aminés alors que la chaine beta en présente 146 (pour voir la liste des acides aminés cliquer ici),
mais, ces deux chaines
ont la même structure secondaire : en hélice .
En effet chaque chaine forment huit hélices alpha qui se replient pour former une cavité hydrophobe
(qui évite l'eau) qui abritera la porphyrine et le fer (l'hème) ou viendra se loger la
molécule de O2.
On peut donc en déduire deux fonctions de la protéine qui entourent l'hème:
- une mise en position optimale de la molécule de O2
- une protection contre l'oxydation
Pour faciliter la comparaison entre sous-unité on utilise habituellement la
nomenclature stéréochimique qui consiste à désigné chaque hélice par une lettre
allant de A à H, l'histidine proximale, à laquelle est rattaché la porphyrine et l'atome de fer,
se trouve toujours en position F8. Si l'on applique la nomenclature linéaire celle-ci occupe la position 87 ou 92 (place de l'acide aminé dans la structure primaire)
selon s'il s'agit de la chaîne alpha ou béta.
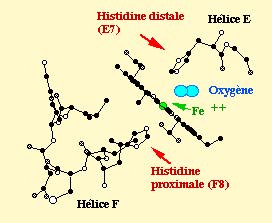
l'hème
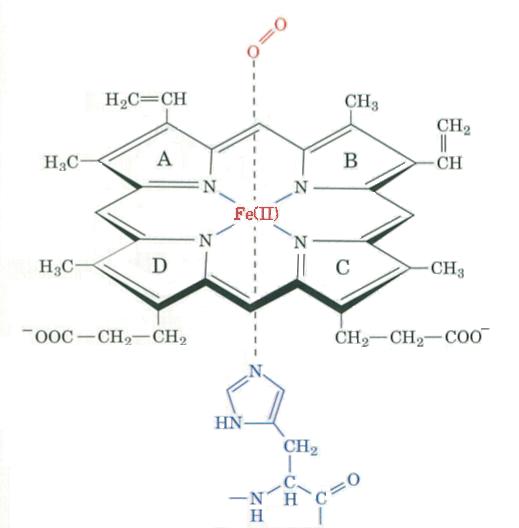
Ci contre la molécule d'un hème d'une oxyhémoglobine accroché à une molécule de O2 et à l'histidine proximale
Une molécule d'hème est constituée d'une porphyrine et d'un atome de fer, il y a donc
un hème par globine. C'est une molécule plane ou légerement bombée selon le groupe liée à
la 6eme liaison que peut former le fer.
Dans l'oxyhémoglobine, l'atome de fer présente 6 liaisons : 4 interviennent
dans la structure de l'hème, la cinquième "amarre" l'hème à la chaine protéique au niveau d'une histidine
appelé histidine proximale (toujours placée en position F8 quelquesoit la chaine), et la sizieme
fixe une petite molécule comme le dioxygène, cette molécule est appelée ligand. Ce
ligand est en rapport avec l'histidine E7 appelée histidine distale.
Dans la déoxyhémoglobine il n'y a aucun ligand dans la face distale de l'hème et
suite à une distribution différentes des électrons dans les couches périphériques, le volume de cet atome
augmente, on dit alors qu'il est en haut spin (contrairement à l'oxyhémoglobine ou le fer est dit bas spin)
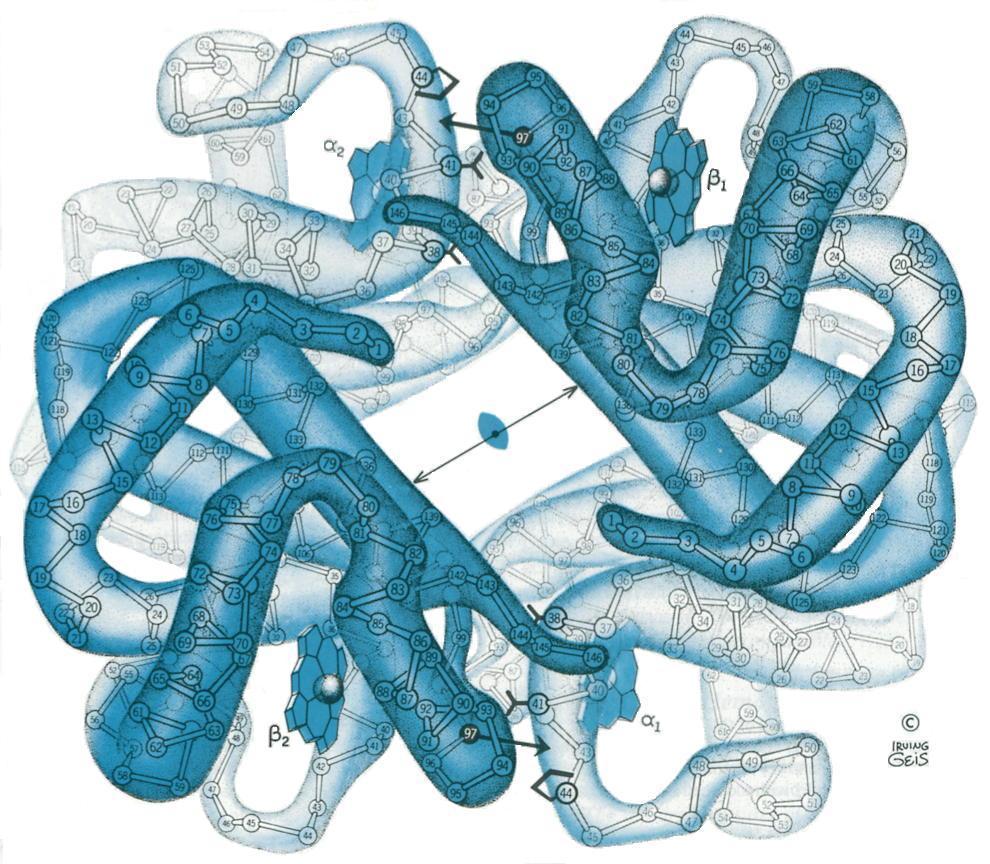 <--->
<--->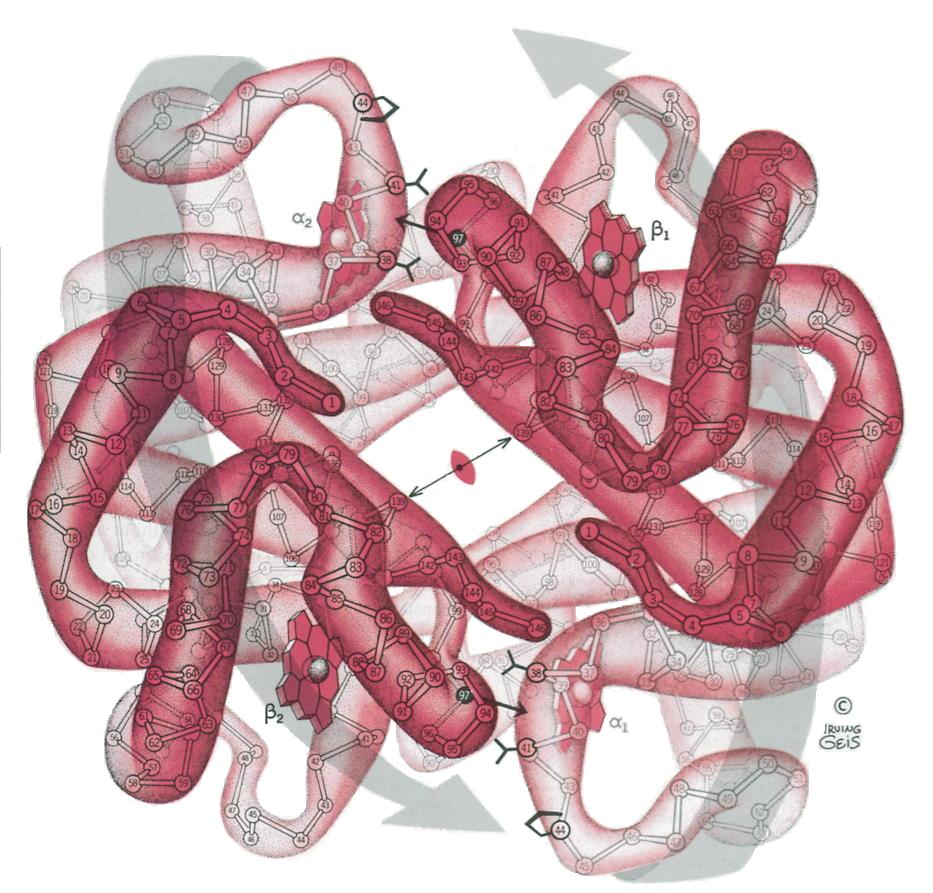
Ci dessus la deoxyhemoglobine en bleu et l'oxyhemoblobine, on remarque
nettement la différence de taille entre les deux protéines dûe à l'état du fer (haut spin ou bas spin)
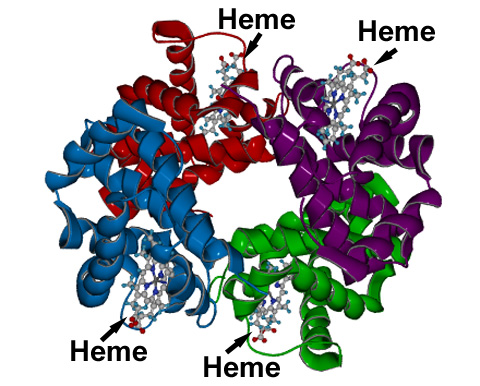
Cette photographie montre la structure quaternaire de
l'hémoglobine : les deux chaines alpha sont représentés en bleu et violet et les deux chaines beta en
rouge et vert. Chaque hème est "imbriqué" dans une cavité hydrophobe formée par les chaines
protéiques.
Grâce au logiciel Rasmol que vous pouvez télecharger gratuitement
sur internet, on peut visualiser l'hémoglobine :
Faites File/open/logici~1/prot et Hba dans la colonne de gauche, la molécule apparait alors, vous pouvez changez
le mode d'affichage avec toutes les commandes de Display pour afficher les molécules, les chaines, la chaine carbonée etc.
Vous pouvez aussi changez les couleurs avec Colours: nous vous conseillons de mettre colours/chain